Da circa trent’anni a questa parte nel bodybuilding agonistico professionistico si fa largo uso di insulina esogena per fare in modo che le cellule muscolari assorbano più glucosio.
In un certo senso può essere una soluzione per espandere i volumi cellulari, in quanto il glucosio si lega all’ acqua provocando un netto incremento delle sostanze intracellulari, ma per quanto riguarda l’ipertrofia della componente contrattile delle fibre, che avviene attraverso la sintesi di nuove proteine, l’accoppiata
insulina esogena/glucosio esogeno è davvero così utile?
Anche nell’ambito del bodybuilding natural da un decennio abbondante i protocolli sia di “massa” che di definizione prevedono vagonate di carboidrati (ovviamente riducendo drasticamente l’apporto di grassi altrimenti si verificherebbe ciò che verrà descritto nei paragrafi successivi).
La parola “massa” la utilizzo virgolettata perché personalmente ritengo che per stimolare l’ipertrofia, sia nel caso si utilizzino supporti farmacologici che nel caso in cui non si utilizzi nulla, non ha senso ricercare aumenti di massa (che significa di peso) iper-alimentandosi e quindi fornendo substrati per la crescita anche al tessuto adiposo.
I meccanismi metabolici descritti in questo articolo, dovrebbero stimolare nel lettore alcuni processi di pensiero analitico atti ad elaborare un ragionamento, perché comprendendo (almeno in minima parte) come un organismo funziona biochimicamente, si possono abbandonare alcune convinzioni paradigmatiche (un paradigma è un insieme di abitudini generatesi da una stringa genetica e consolidate a causa dell’ambiente in cui si è cresciuti, relazionati e formati).
L’ORMONE DELL’ANABOLISMO
(Brevi cenni sulla struttura e sul funzionamento della molecola)
Tutti coloro che si allenano con i sovraccarichi per stimolare una risposta ipertrofica, ergo, che vogliono diventare enormi sanno (o dovrebbero sapere almeno in parte…) quanto sia indispensabile l’insulina, essendo l’ormone che “trasporta” il glucosio nei muscoli ed in altri tessuti del corpo attraverso la circolazione sanguigna.
Per questo motivo si cerca di fare in modo di promuovere un picco insulinico volontariamente, assumendo fonti di carboidrati da cui l’organismo ricava glucosio per stimolare la secrezione endogena di insulina.
Infatti quella fase in cui l’organismo aumenta la richiesta di nutrienti finalizzandoli allo stimolo ipertrofico ed al ripristino delle riserve depauperate, viene definita finestra anabolica.
Però non bisogna tralasciare un fattore chiave, ovvero che L’INSULINA È ANABOLICA PER TUTTI I TESSUTI, quando secreta in risposta ad introduzioni glucidiche superiori alle richieste dell’organismo e soprattutto bisogna essere a conoscenza che esiste una via alternativa che fa in modo che le cellule possano recepire il glucosio necessario per soddisfare le proprie esigenze energetiche, anche senza ricercare ipersecrezioni dell’ormone mangiando chili di carboidrati.
(Vedi GLUT-4 nella sezione successiva dell’articolo).
Un’altra importante azione dell’insulina è quella di stivare amminoacidi nella cellula stimolandone il passaggio dal sangue alle cellule, analogamente alla funzione che svolge nei confronti del glucosio.
Essa ha un ruolo sullo stimolo della sintesi proteica, ma il meccanismo non è innescato dall’introduzione esogena di glucosio, ma dalla concentrazione ematica di determinati amminoacidi che a loro volta stimolano il rilascio di ormoni che hanno la funzione di stimolare la produzione endogena di glucosio, che è ben altra storia…
(questo fenomeno verrà descritto in seguito nel corso dell’articolo).
L’azione anabolica dell’insulina che ha a che fare con la costruzione di tessuto magro muscolare, non è quindi direttamente legata all’ingestione di carboidrati per ottenere concentrazioni ematiche elevate di glucosio e relativi picchi glicemici.
INSULINA E SINTESI PROTEICHE
L’insulina una volta legata ai recettori di membrana cellulari scatena una cascata di reazioni, come la conservazione ed incremento delle riserve energetiche (glicogenosintesi, lipogenesi) e la stimolazione della sintesi proteica.
Questo punto è correlato a ciò che ho scritto nel paragrafo precendente dell’articolo poiché l’incremento plasmatico di aminoacidi derivati dalla digestione delle proteine, soprattutto di leucina, valiana, isoleucina e arginina, stimola la secrezione di ormoni iper-glicemizzanti quali glucagone, ormone della crescita e relativo fattore di crescita insulino-simile.
Questi ormoni a loro volta stimolano la secrezione di insulina, con cui sinergicamente stivano gli aminoacidi nelle cellule e li rendono disponibili per le sintesi proteiche.
Al contrario l’insulina secreta in risposta all’aumento della glicemia in seguito ad assunzione glucidica, diventa antagonista di questi ormoni, poiché la sua azione in questa situazione metabolica è fortemente ipoglicemizzante.
PRODUZIONE E SECREZIONE DELL’ INSULINA
L’insulina è un ormone proteico, essendo costituita da due catene peptidiche rispettivamente di 21 aminoacidi (catena A) e 30 aminoacidi (catena B).
Le due catene sono collegate da un ponte disolfuro (due atomi di zolfo legati tra loro). Oltre alle due catene, che rappresentano la componente attiva della molecola, inizialmente si trovano collegate all’ ormone anche una sequenza segnale ed il peptide C, per un totale di 104 aminoacidi.
L’insulina viene prodotta nel nucleo delle cellule β del pancreas e per essere attiva necessita l’ingresso nel reticolo endoplasmatico (REL), dove si verificano modifiche a carico della molecola, che consistono nel distacco della sequenza segnale. L’insulina a questo punto viene inglobata in vescicole secretorie.
L’ ultimo passaggio per rendere attivo l’ ormone avviene nel Golgi, dove viene rimosso il peptide C.
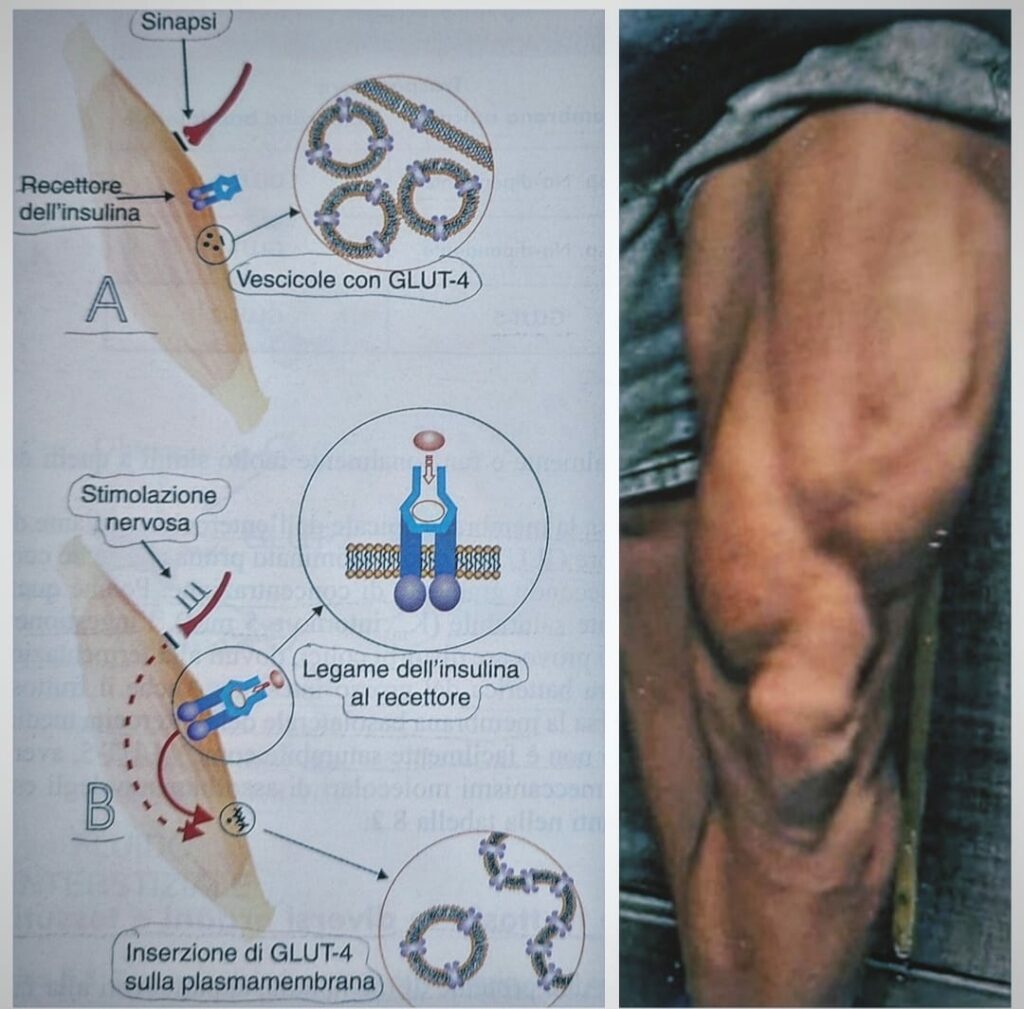
Quando il glucosio entra nelle cellule β (l’ ingresso avviene attraverso le GLUT-2 secondo gradiente di concentrazione) avvia il processo di glicolisi con produzione di ATP.
Questo passaggio genera la chiusura dei canali ATP-dipendenti del potassio e l’aumento concomitante di ioni calcio a livello citoplasmatico (Ca++), perché il glucosio interagisce anche con i sensori dei canali del calcio, favorendone l’ apertura.
Questo processo stimola il rilascio per esocitosi (significa fuoriuscita dalla cellula) delle vescicole contenenti insulina. L’ insulina in circolo può fondere con la plasmamembrana delle cellule bersaglio.
IL GLUCOSIO PER ENTRARE NELLE CELLULE NECESSITA SEMPRE INSULINA?
L’ ingresso nelle cellule del glucosio proveniente dal circolo ematico è mediato dalle proteine trasportatrici intracellulari GLUT.
Le cellule dispongono di sette trasportatori intracellulari del glucosio (sodio-dipendente, GLUT-1, GLUT-2, GLUT-3, GLUT-4, GLUT-5 e GLUT 7, quest’ ultima è presente solo nel fegato), che operano nei differenti distretti tissutali del corpo.
In condizioni normali, ovvero quando la glicemia è stabile (85 ng/dl) e la richiesta energetica della cellula non è maggiorata da esigenze specifiche, il passaggio del glucosio dal circolo ematico alla cellula avviene secondo gradiente di concentrazione, ed in questo caso significa che per andare incontro ai processi metabolici il glucosio passa dall’esterno all’interno delle cellule senza stimolo dell’insulina, perché le sostanze tendono normalmente a spostarsi da distretti in cui la concentrazione è maggiore a distretti in cui è minore.
Quando, invece, nel sangue si verifica un picco glicemico dovuto all’ ingestione di cibi contenti carboidrati e/o zuccheri, essendo indispensabile una maggiore “spinta” verso la cellula, il glucosio in eccesso stimola la secrezione di insulina, ed a sua volta l’ ormone ne amplifica l’ ingresso all’ interno.
L’attivazione del recettore da parte dell’ insulina comporta all’ interno della cellula la fusione con la plasmamembrana delle vescicole contenenti il trasportatore GLUT-4, proteina che media l’ingresso del glucosio nelle cellule dei tessuti muscolari, cardiaci e adiposi.
Tuttavia il sistema di trasporto del glucosio specifico del muscolo GLUT-4 è attivato oltre che dall’insulina, anche da stimolazione nervosa, infatti, il consumo di glucosio esterno (proveniente dal circolo) da parte del muscolo in attività è favorito sia dall’aumento del flusso di sangue e ossigeno, legato alla vasodilatazione, sia dall’aumento della velocità di trasporto di glucosio nelle fibrocellule muscolari.
EFFETTI ANABOLICI DELL’INSULINA
Chi ha come obiettivo l’aumento della massa muscolare ovviamente si allena duramente con i sovraccarichi in maniera costante.
I meccanismi energetici adoperati dalle cellule in condizioni di carenza di ossigeno che scaturiscono dalla tensione intramuscolare che si accumula ripetizione, dopo ripetizione, consumano glicogeno/glucosio, attraverso reazioni cataboliche (glicogenolisi e glicolisi).
Le riserve di questi substrati vanno quindi reintegrate insieme agli incrementi delle sintesi proteiche, in modo da generare tessuto magro in esubero (è questo l’obiettivo giusto?…).
L’insulina in questo caso è amica dei muscoli in quanto stimola l’assunzione dei metaboliti energetici nelle cellule bersaglio, l’accumulo di nutrienti energetici come riserva e le biosintesi di proteine e geni.
Inoltre nei muscoli e negli adipociti stimola l’assunzione di glucosio e nel fegato e nei muscoli la sintesi di glicogeno ed inibisce i sistemi di degradazione intracellulare delle proteine.
Tuttavia l’insulina provoca effetti indesiderati per chi vuole mantenere una bassa percentuale di grasso, soprattutto se secreta in risposta ad un eccesso di concentrazione ematica di glucosio dovuta ad introduzioni esogene eccessive di carboidrati.
Nel fegato, infatti, promuove la glicolisi e la sintesi degli acidi grassi e blocca la gluconeogenesi (meccanismo catabolico e anche lipolitico che utilizza substrati per generarne altri, ovvero glucosio).
Inibire cronicamente la gluconegenesi ostacola il dimagrimento, o comunque, facilita l’accumulo di grasso in quanto segnala che l’energia in entrata è sempre superiore a quella in uscita.
Nel tessuto adiposo stimola la sintesi di trigliceridi, favorita dall’abbondanza di glucosio e acidi grassi provenienti dalla circolazione e lavorati dal fegato.
L’ INSULINA È ALTAMENTE LIPOGENA
La sintesi degli acidi grassi avviene principalmente nel fegato.Il tessuto adiposo, invece, li attiva legandoli al CoA e li esterifica con il glicerolo.
Il glicerolo però non può essere fosforilato (il meccanismo di fosforilazione è descritto in seguito) nel tessuto adiposo, quindi la sintesi di trigliceridi necessita di un intermedio della glicolisi, il glicerolo-3-fosfato.
Pertanto gli adipociti devono utilizzare glucosio per la sintesi dei trigliceridi e di conseguenza sono i livelli di glucosio a regolare anche la sintesi degli acidi grassi, incrementando i livelli epatici di malonil-CoA intermedio chiave della biosintesi degli acidi grassi.
Questo articolo ovviamente non è un trattamento di biochimica, ma per gestire certe informazioni sarebbe opportuno conoscere alcuni meccanismi metabolici importanti.
La molecola fondamentale al centro della discussione è il glucosio. La glicolisi è quell’insieme di processi che all’interno della cellula fanno si che il glucosio venga demolito per accumulare energia sottoforma di ATP.
La molecola di glucosio ha sei atomi di carbonio ed il carbonio è l’elemento della vita.
Le molecole organiche “giocano” tutto il tempo con gli atomi di carbonio, come se fossero mattoncini dei lego da aggiungere e togliere.
La glicolisi scinde in due la molecola di glucosio, ottenendo due molecole di piruvato che hanno rispettivamente tre atomi di carbonio.
Per entrare nel ciclo di Krebs il piruvato deve essere decarbossilato. Questo processo, che sottrae un carbonio al piruvato, forma acetilCoA, che di atomi di carbonio ne possiede due.
L’acetilCoA entra nel ciclo di Krebs, che si svolge nel mitocondrio (la glicolisi avviene nel citosol).
Se l’acetilCoA derivato dalla decarbossilazione del piruvato è in esubero (introduzione eccessiva di carboidrati o di grassi e carboidrati insieme), viene carbossilato a malonil-CoA, composto a tre atomi di carbonio, utilizzando un atomo di carbonio proveniente dal bicarbonato.
Questo composto, sempre nel citosol della cellula, incontra l’acido grasso sintasi, un complesso enzimatico multiproteico che “monta” catene di acidi grassi unendo molecole di acetilCoA.
Tutto questo avviene nel fegato, che quindi sintetizza acidi grassi e li immette in circolo legati alle VLDL (lipoproteine che trasferiscono gli acidi grassi dal fegato ai vari tessuti del corpo) che li trasportano al tessuto adiposo.
SENSIBILITÀ INSULINICA
Mantenere i recettori sensibili all’insulina è più importante dell’ottenerne una massiva secrezione di insulina da parte del pancreas in risposta all’aumento della glicemia nel sangue.
Più sensibilità significa più ingresso di glucosio nella cellula con meno insulina.
La fusione delle vescicole contenenti insulina con la membrana è stimolata dall’enzima fosfoinositolo trifosfato isochinasi (il fosfatidilinositolo è un fosfolipide che si trova nel versante interno membrane cellulari).
Questa stimolazione è alla base dell’aumento della sensibilità cellulare all’insulina, perché il legame dell’insulina con il recettore forma il complesso insulina-recettore, generando la reazione di autofosforilazione dell’enzima tirosina chinasi, che fa parte della componente recettoriale che sporge nella porzione interna della membrana.
In breve la fosforilazione è l’aggiunta di un gruppo fosfato ad una catena laterale di un amminoacidico tra serina, treonina o tirosina.
Questa reazione attiva la proteina e la rende in grado di promuovere una reazione, essendo capace di rilasciare energia. Determinati enzimi, invece, si attivano mediante defosforilazione, come la glicogeno sintasi, che costruisce catene di glicogeno unendo singole molecole di glucosio.
Ad esempio la glicogeno fosforilasi, enzima che smonta molecole di glucosio dalle catene di glicogeno per creare energia, funziona soltanto in forma forforilata.
L’insulina attiva la glicogeno sintasi, inducendone la defosforilazione.
Da questa reazione viene attivata nel citosol la proteina substrato dell’insulina (IRS), responsabile di tutti quei meccanismi che fanno entrare il glucosio nella cellula.
Un bilancio energetico sempre in positivo, soprattutto dovuto ad un eccessiva assunzione di carboidrati, induce il mantenimento delle forme attive degli enzimi di sintesi (anabolici), provocando uno squilibrio nella normale gestione dei nutrienti da parte delle cellule.
Questo in cronico, provoca l’insulino-resistenza, che consiste nella mutazione di aree recettoriali specifiche, determinando l’impossibilità degli amminoacidi di essere fosforilati e compromettendo l’integrità e la funzionalità del recettore.
A causa di questo l’ingresso del glucosio nella cellula subisce una drastica riduzione, perché le membrane divengono meno permeabili a causa della mutazione recettoriale.
(nell’articolo del seguente link è presente una sezione in cui è scritto come mantenere integre le membrane cellulari)
GLUCAGONE L’ANTAGONISTA PER ECCELLENZA
Il glucagone è un polipeptide secreto dalle cellule α delle isole pancreatiche in risposta a bassi livelli di glucosio nel torrente ematico
(le cellule α sono localizzate nel tessuto principale del pancreas, chiamato parenchima, accanto alle cellule β).
È infatti definito l’ormone del digiuno ed è un forte antagonista dell’insulina. Il suo rilascio provoca effetti sia sul metabolismo del glucosio, sia su quello degli acidi grassi.
Promuove infatti la glicogenolisi, blocca la glicogenosintesi e blocca la glicolisi idrolizzando il fruttosio-2,6-bisfosfato e inibendo la piruvato chinasi, enzima che conduce alla formazione di piruvato, attraverso la cessione del gruppo fosfato all’ ADP da parte del fosfoenoil-piruvato*.
Questo passaggio è determinante, poiché la glicolisi demolisce il glucosio, mentre la gluconegenesi compone il glucosio, quindi per non creare un ciclo privo di significato energetico, il glucagone inibisce questi componenti chiave della glicolisi, stimolando la gluconeogenesi attraverso l’aumento della concentrazione di fosfoenoil-piruvato, che al contrario nella glicolisi cede il fosfato convertendosi in piruvato*.
In termini spiccioli la glicolisi produce energia demolendo glucosio, mentre la gluconegenesi, che si manifesta quando la glicemia è troppo bassa durante digiuno e/o attività fisica intensa e duratura, costruisce glucosio utilizzando energia già presente nell’organismo, demolendo grassi, amminoacidi (soprattutto non essenziali, non preoccupatevi…) ed ancora lattato e piruvato durante lo sforzo fisico.
Ovviamente il glucosio generato prenderà le vie della glicolisi per creare energia, ed il ciclo continua.
Essendo che quelle che sto descrivendo, sono circostanze cataboliche, è ovvio che non possono al contempo verificarsi situazioni anaboliche.
Il glucagone infatti inibisce la sintesi di acidi grassi nel fegato riducendo la concentrazione di piruvato e l’attività dell’ acetil-CoAcarbossilasi (enzima che catalizza la formazione di malonil-CoA a partire da bicarbonato e acetil-CoA), e favorisce l’incremento dell’AMP ciclico negli adipociti.
La funzione di attivazione dell’AMP ciclico, molecola segnale che attiva diversi enzimi chinasi (fosforilatori) deputati alla produzione di energia, avviene quando il glucagone si lega al recettore specifico nel fegato, mentre l’adrenalina può scatenare la stessa risposta sia nel fegato, che nei muscoli.
L’AMP ciclico attiva le chinasi che fosforilano le HSL (lipasi sensibile agli ormoni), che idrolizzano i trigliceridi in acidi grassi liberi e glicerolo (il glicerolo è precursore nella gluconegenesi).
CONCLUDENDO
L’insulina è un ormone che regola l’omeostasi del glucosio nel sangue, ed il glucagone è la controparte. Se il glucosio è alto a seguito di ingestione di glucidi, l’insulina si innalza ed il glucagone si abbassa.
A digiuno, quando la glicemia è bassa, il glucagone si innalza e l’insulina rimane bassa.
Il glucosio è un nutriente importante, ma introdurre troppi carboidrati, ben oltre il fabbisogno, non serve per stimolare ipertrofia muscolare.
L’ipertrofia è un fenomeno adattativo riguardante la componente contrattile dei muscoli scheletrici, che quando sottoposti a tensione meccanica reagiscono scatenando una miriade di eventi cellulari, in cui sono coinvolti ormoni, nutrienti, ed altre sostanze, ma i muscoli abbisognano quantità precise di glucosio per funzionare, ma funzionano efficientemente anche senza.
Quote di glucosio che non possono essere stivate o adoperate dai muscoli come fonte energetica durante lo sforzo, vengono convertite in grasso.
Nemmeno la sintesi proteica necessita ipersecrezioni di insulina e quindi non è necessario provocare picchi dell’ormone volontariamente mangiando glucidi, perché bastano concentrazioni ematiche di determinati aminoacidi per far si che ne venga secreta la quantità necessaria.
“L’allenamento è il fattore che orienta le cellule verso le reazioni biochimiche che conducono alla loro espansione.
Tali reazioni, per avvenire, necessitano quantitativi adeguati di energia, che deve provenire dalla demolizione dei macronutrienti.
Se l’allenamento manda il segnale, la risposta è quindi data dal processo di crescita che si verifica, e ciò consentirà di stabilire e rimodulare la quota di nutrienti necessaria.
L’errore madornale è modulare le quote a priori, stabilendo la quantità di nutrienti in funzione di quanta crescita si vuole ottenere”.
Di Scilipoti Nino